Cette expérience de physique amusante est facile à réaliser.
Matériel
- le nécessaire pour faire du gel d’agar agar
- du colorant alimentaire
- un récipient en verre allongé que l’on peut fermer hermétiquement (tube pour épices, ou gousse de vanille, petit pot de yaourt)
- feuille de papier petits carreaux (non indispensable pour ceux qui ne veulent pas de faire de mesures)

Expérience
Remplir le récipient en verre allongée de gel d’agar agar. Pour ce faire, on peut mettre de la poudre d’agar agar dans de l’eau chaude (3 ou 4 fois la dose proposée pour des préparation culinaires) . Verser ensuite le contenu dans les récipients en prenant soin de ne pas les remplir complètement. Laisser refroidir et le liquide va se gélifier.
Une fois le gel à température ambiante, mettre du colorant alimentaire (mélangé éventuellement à de l’eau) au dessus du gel pour occuper tout le volume des récipients, comme sur la photo ci-dessous.

Fermer les récipients hermétiquement puis les placer horizontalement sur une feuille blanche quadrillée (plutôt petits carreaux pour ceux qui veulent faire des mesures). Observer l’évolution des récipients sur plusieurs jours.

Observations
On peut constater que le colorant alimentaire diffuse au cours du temps dans le gel d’agar agar. Le colorant alimentaire se déplace sur plusieurs centimètres en quelques jours. Le front du colorant atteint 5mm en 5h, 1cm environ en 1 jour, puis 3 cm en 6 jours.
Sur des temps « courts », la diffusion du colorant s’effectue de la même manière dans les deux récipients, tant que le colorant est assez loin de l’autre extrémité du récipient utilisé.




Que se passe-t-il ?
 Cette expérience met en évidence la diffusion d’un liquide (le colorant alimentaire) dans du gel. Ce sont les mouvements microscopiques des molécules de colorant (et d’eau) générés par l’agitation thermique qui sont responsables de la diffusion de molécules.
Cette expérience met en évidence la diffusion d’un liquide (le colorant alimentaire) dans du gel. Ce sont les mouvements microscopiques des molécules de colorant (et d’eau) générés par l’agitation thermique qui sont responsables de la diffusion de molécules.
Dans la nature, il existe deux manières de transporter de la matière : par diffusion ou par convection. Contrairement à la convection, la diffusion est un phénomène de transport sans mouvements macroscopiques de matières qui peuvent avoir lieu essentiellement dans les liquides et les gaz. Dans le gel, il n’y a aucun mouvement macroscopique donc aucun transport par convection du colorant, d’où l’intérêt de l’expérience.
La diffusion de molécules a lieu dès lors qu’une espèce chimique n’a pas une concentration homogène dans le milieu considéré. Ici, la concentration du colorant dans le gel est initialement nulle mais pas dans le réservoir de droite. La diffusion aura lieu tant que la concentration du colorant rouge ne sera pas homogène dans tout le récipient.
Tant que le front du colorant est assez loin de l’autre extrémité des récipients, la diffusion est régie par la même équation dans les deux cas et les mêmes conditions aux limites. On observe ainsi que, sur les temps « courts », la diffusion s’effectue de la même manière dans les deux récipients étudiés. Le processus ne dépend pas de la section du récipient.
Le deuxième récipient allongé étant moins long que le premier, la concentration du colorant devient homogène dans ce dernier plus rapidement.
Pour aller plus loin
Lors de l’expérience précédente, on peut étudier la position du front du colorant dans le gel en fonction du temps en utilisant la feuille de papier petits carreaux. On peut constater que le front n’avance pas à vitesse constante et que donc sa position n’est pas une fonction linéaire du temps. Si c’était le cas, comme le colorant avance de 1.0 cm en 1 jour, il devrait se déplacer de 6 cm en 6 jours. Or il se déplace plutôt de 3.0 cm (cf photos et vidéo ci-dessus).
Lorsque les physiciens mettent en équation le processus de diffusion de particules, ils prévoient que la position du front est une fonction de la racine carrée du temps. Le processus est donc de moins en moins efficace avec le temps. Il s’agit d’une caractéristique commune à tous les processus diffusifs (diffusion de particules, diffusion de la chaleur, ou diffusion de la quantité de mouvement), ces processus étant régis par l’équation que les physiciens appellent l’équation de diffusion.
Pour les plus curieux, nous avons compilé dans la courbe ci-dessous les résultats observés lors de l’expérience dans le tube plus allongé (type tube à épices ou tube à essai de chimie) .
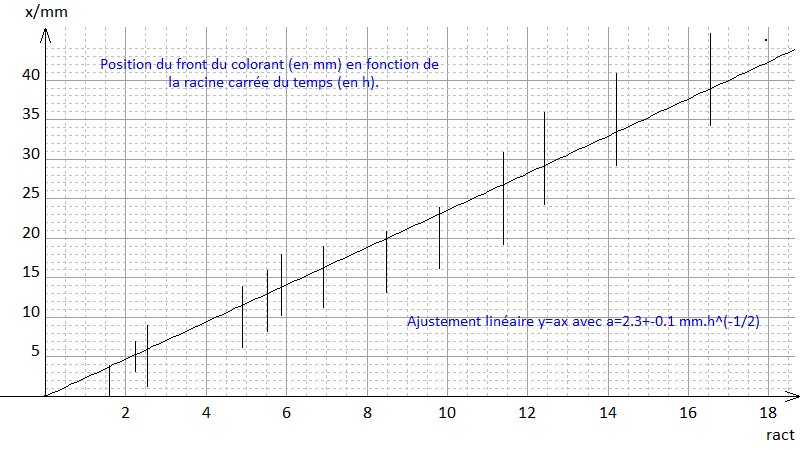
Sur la courbe, nous avons tracé la position du front du colorant (en mm) en fonction de la racine carré du temps (en h^(1/2)). Nous constatons bien que la loi d’échelle prévue par les physiciens issue de la résolution de l’équation de diffusion est en accord avec l’expérience (cf la droite de meilleur ajustement passant par l’origine).
Le transport de matières par diffusion est en général moins efficace et moins rapide que le transport de matières par convection.
